Producción de hidrógeno: métodos convencionales. Parte 2.

Como vimos en Producción de hidrógeno: métodos convencionales. Parte 1, la demanda energética aumenta año con año. Siendo los combustibles fósiles la principal fuente de energía en la actualidad. Solo que esta manera de producir electricidad no puede ser eterna, pues proviene de recursos no renovables. Además de afectar directamente al cambio climático. Tratando de resolver ambos problemas, energía y cambio climático, se han desarrollado tecnologías que son muy útiles. Ejemplos claros de esto es la energía solar y la energía eólica.
Ahora surge una nueva interrogante ¿Cuál será la manera más eficiente de transportar y almacenar esa energía? Una de las propuestas es el uso de hidrógeno, un gas noble que no genera CO2 en su combustión. En la primera parte vimos la definición de procesos convencionales, siendo el producto de reacciones termoquímicas. A su vez, vimos el Reformado con vapor de agua y la oxidación parcial como métodos para producir hidrógeno. En esta ocasión analizaremos la Pirolisis, la Gasificación de biomasa y la electrólisis.
Pirolisis
Este proceso consiste en la descomposición de un combustible sólido mediante la acción de calor en ausencia de oxígeno [1]. Para este método se necesita una temperatura entre 625 °K y 775 °K [2]. Existen 3 subdivisiones dentro de esta manera de obtener hidrógeno: Pirolisis convencional; Pirolisis rápida; Pirolisis instantánea. A continuación, sus diferencias en la siguiente tabla [3].
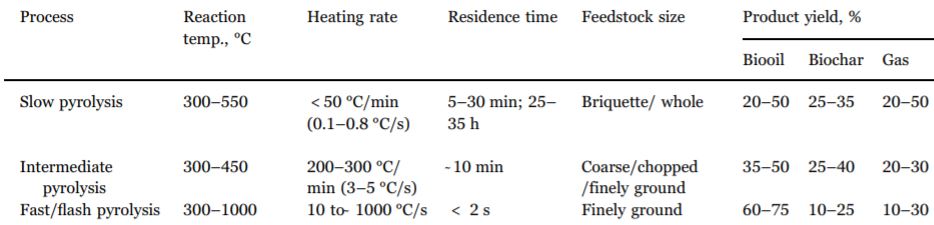
En residuos sólidos urbanos la pirolisis genera hidrocarburos líquidos que se pueden reformar para obtener hidrógeno.
Gasificación
Este proceso es una combustión incompleta donde se obtienen diversos gases como CO, CO2, H2 y CH4 [1]. Usualmente se emplea carbón o biomasa (madera, papel, aserrín…). Además, se lleva a cabo a una temperatura mayor a los 700 °C y menor a 850 °C [2]. La eficiencia de este método varía según el combustible utilizado, tipo de gasificador y agente de la gasificación. Aun así, el rendimiento de este procedimiento es relativamente bajo.
Electrólisis
Mediante este procedimiento se obtiene la disociación de la molécula de agua en oxígeno e hidrógeno por el paso de una corriente eléctrica [2]. Siendo su eficiencia dependiente de la energía eléctrica utilizada durante el proceso. Usualmente cuenta con un promedio que va desde el 25 hasta el 45 por ciento. En la actualidad, la electrólisis se desarrolla por medio de varias vías, alcalina, membranas poliméricas o de intercambio de protones (PEM) y celdas de electrólisis de óxido sólido [2]. A pesar de eso, la electrolisis no demanda altas temperaturas (18 – 40 °C), pero sí demasiada energía eléctrica. Además de contar con bastantes y complejos pasos. Por lo anterior, procesos como la gasificación y la pirolisis siguen siendo empleados, e inclusive llegan a ser preferidos.
Conclusión
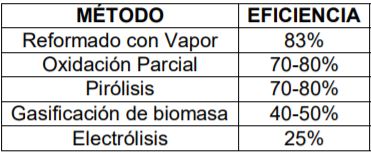
Hemos abarcado todos los métodos convencionales para la obtención de hidrógeno. Pues recordemos que no se encuentra libre en el ambiente, debe ser sometidos a distintos procesos. Cada uno de estos métodos presenta cosas buenas y desventajas, sería elección de los usuarios determinar lo mejor para ellos. Además de que siempre están mejorándose a través del tiempo debido a su constante investigación. No podemos determinar una mejor que la otra, pero esperamos que esta información sea base para su elección. A continuación, una tabla que muestra a eficiencia de cada método convencional.
Bibliografía
[1] García, L. (2017, 24 abril). PRODUCCIÓN CATALÍTICA DE HIDRÓGENO MEDIANTE REFORMADO CON VAPOR DE COMPUESTOS OXIGENADOS. UNIVERSIDAD REY JUAN CARLOS.
[2] Mahecha, E. A. (2018, mayo). USO DEL HIDRÓGENO COMO FUENTE ALTERNATIVA PARA ALIMENTAR PILAS DE COMBUSTIBLE. FUNDACIÓN UNIVERSIDAD DE AMÉRICA FACULTAD DE EDUCACIÓN PERMANENTE Y AVANZADA ESPECIALIZACIÓN EN GESTIÓN AMBIENTAL BOGOTÁ D.C.
[3] Roy, P., & Dias, G. (2017). Prospects for pyrolysis technologies in the bioenergy sector: A review. Renewable and Sustainable Energy Reviews, Vol. 77. p. 59-69. https://www.sciencedirect.com/science/article/abs/pii/S1364032117304719






